近日,我校生物反应器工程国家重点实验室及校光遗传学与合成生物学交叉学科研究中心杨弋、朱麟勇、陈显军教授及浙江大学任艾明研究员组成的研究团队在活细胞RNA成像技术研究中取得突破性进展🤚🏽🤦🏿♀️,在国际方法学权威学术期刊《自然—方法》(Nature Methods)以长篇论文(article)形式在线发表题为“Large stokes shift fluorescent RNAs for dual-emission fluorescence and bioluminescence imaging in live cells”的研究文章。

RNA是活细胞中最重要的生物大分子之一,它不仅能将遗传信息从DNA传递到蛋白质,还在各种细胞生命活动的功能调控方面发挥重要作用。活细胞中的RNA是高度时空动态变化的👵🏼😡,它们往往需要在特定的时间🩻、空间和丰度下才能执行正确的生物学功能🧏🏻♂️。因此,发展活细胞RNA成像技术对于探究RNA的复杂时空动态变化规律和生物学功能至关重要😤。荧光RNA是近年新兴发展的RNA荧光标记与成像技术🤹,其原理是利用RNA适配体作为标签,特异性结合小分子染料并激活其荧光。相较于其他RNA标记与成像技术,荧光RNA具有操作简单直接🧘🏼♀️、对靶标RNA干扰小🌍、信噪比高等优点👩🏼🍳。研究人员只需要将靶标RNA序列与荧光RNA适配体序列融合👿,加入染料配体即可实现靶标RNA的低背景原位实时标记与成像。
杨弋教授与朱麟勇教授组成的交叉学科联合攻关团队此前发展了Pepper系列高性能荧光RNA📈,在国际上首次实现高等生物细胞内不同种类RNA的原位标记与高信噪比成像🏃🏻♀️➡️,成功解决了活细胞RNA实时标记与成像的难题(Nature Biotechnology, 2019; Nature Chemical Biology, 2021)。然而,许多细胞生命过程需要多种RNA分子的同时参与🤹🏽♂️。因此🧔🏿,亟需发展具有生物正交的高性能荧光RNA来实现活细胞内多种RNA分子的同时标记与成像👱🏿♂️,进而解析它们的功能与调控机制。针对这一技术挑战,研究团队历经多年辛苦耕耘👋🏻,最终在荧光RNA技术领域再次取得了突破进展。团队基于全新的分子设计理念与分子共同定向进化策略💴,原创发展了国际上首个可用于细胞成像的大斯托克斯位移荧光RNA🤦🏻♀️,实现了活细胞RNA与基因位点的单激光双发射多色实时成像🕺🏽,并进一步在活细胞与活体动物上完成了RNA-蛋白质相互作用的实时监测🔚。
研究团队发展的Clivia荧光RNA适配体仅由30个核苷酸构成,以纳摩尔级的高亲和力结合不发光的NBSI染料分子🦝,进而激活高亮度荧光👩🏼🏫🗞。研究团队通过对NBSI染料分子进行修饰改造,成功获得了光谱涵盖黄色到红色系列高亮度荧光RNA☝️。这些荧光RNA的斯托克斯位移可达108 nm,且其激发波长与Pepper类似。研究团队结合Clivia和Pepper两种荧光RNA光谱特性🧛🏼,利用单色激光实现了两种活细胞RNA或基因位点的荧光成像🚝。受益于Clivia的小巧结构,它可被插入到多种小核RNA序列中,在不影响这些RNA本身定位与功能的情况下,实现了高信噪比原位实时RNA标记与动态成像。研究团队利用Clivia标记U1小核RNA👨🏿🦰,对细胞应激情况下U-小体的形成过程进行了实时监测👩🏿🍼,发现U-小体在应激压力撤除后仍十分稳定,但在细胞有丝分裂过程中会逐渐变少或消失。研究人员随后基于Clivia发展了RNA-蛋白质相互作用检测技术,首次实现了活体动物中RNA-蛋白质相互作用的原位实时检测。
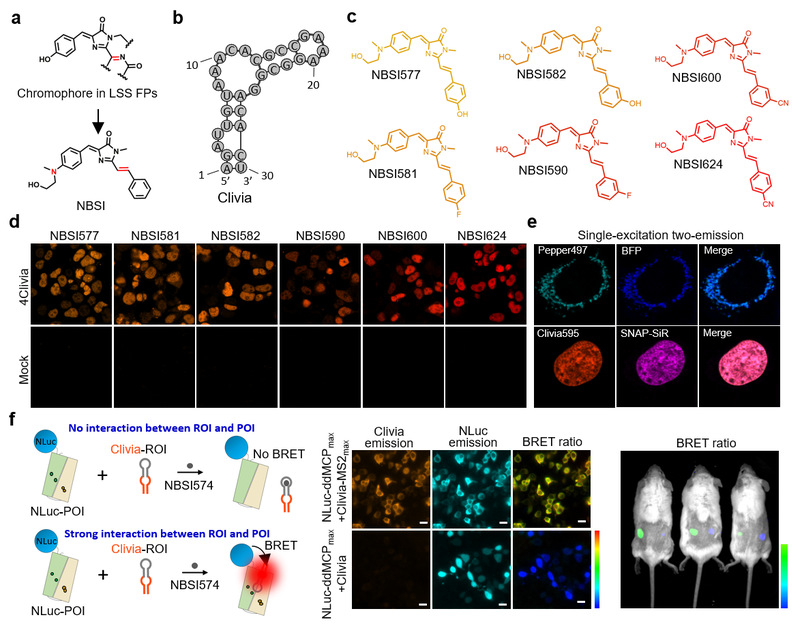
大斯托克斯位移荧光蛋白已被广泛应用于活细胞与活体蛋白质的多色荧光标记与成像🙊👨❤️👨。而Clivia则代表了大斯托克斯位移荧光RNA的原创性突破🌧。Clivia具有高稳定性、高信噪比👩🦳、高亮度,是目前唯一可用于活细胞分析的大斯托克斯位移荧光RNA,也是唯一可在活体上对RNA动态进行测量的荧光RNA。Clivia将为活细胞与活体RNA的多色成像以及RNA功能与调控机制研究提供极具价值的实用工具,也有望为活细胞与活体生物传感、即时诊断甚至实时诊断技术的发展提供新的机遇。
论文第一作者为蒋丽博士、谢鑫博士、苏倪博士、张大生博士📥、陈显军教授、许笑晨博士🧖🏻,通讯作者为杏悦2平台的杨弋教授、朱麟勇教授、陈显军教授,以及浙江大学任艾明研究员🚴♂️。该研究得到了国家重点研发计划⛽️🚝、国家自然科学基金创新群体及原创项目、上海市细胞代谢光遗传学技术前沿科学研究基地、生物反应器工程国家重点实验室基金、上海交通大学医杏悦2附属第六人民医院ALS项目等经费资助🫵🏻。 原文链接https://www.nature.com/articles/s41592-023-01997-7